|
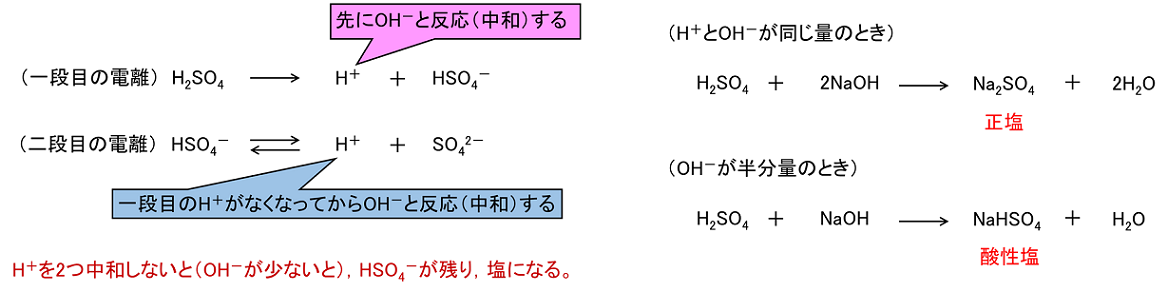
4 塩h 【塩とその分類】 酸から生じる陰イオン(Cl-など)と塩基から生じる陽イオン(Na+な)がイオン結合したもの(NaClなど)が塩である。 H2SO4やH3PO4などの二価や三価の酸は段階的にH+を出すので,中和も段階的に起こる。加える塩基の量が一段目の中和分しかない場合,HSO4-やH2PO4-といった陰イオンと塩基から生じる陽イオンからNaHSO4やNaH2PO4といったHを含んだ塩ができる。このようにHが残っている塩を〔 酸性塩 〕という。同様にOHが残っている塩もあり,これらを〔 塩基性塩 〕という。また,NaClなどHやOHが残っていない塩を〔 正塩 〕という。 (注意)この呼び方は「酸性を示す」,「塩基性を示す」,「中性を示す」という意味ではない。 |
||
 |
||
|
【塩の水溶液】 塩は水溶液中では,電離して陰イオンと陽イオンとして存在している。塩は断りがない限り電離度を1とする。塩は酸と塩基の中和によってできるが,塩の水溶液は必ずしも中性ではない。これは塩の電離によって生じた陰イオンや陽イオンが水H2Oと反応してH+やOH-が作られることがあるからである。弱酸のイオンは水と反応してOH-を,弱塩基のイオンは水と反応してH+を生成する。
CH3COO-など弱酸のイオン 弱酸のイオンの性質は,弱酸の電離から考えることができる。弱酸は電離度が小さいので,「⇄」の電離をする。酢酸の場合は次のように電離する。 CH3COOH ⇄ CH3COO-
+ H+ 酢酸は電離度が小さいので,多くはCH3COOHの形(反応式の左側)で存在する。つまり,上の式では「←」のほうが起こりやすく,酢酸イオンCH3COO-はH+があれば結合してCH3COOHになる傾向が強い。そのため,酢酸ナトリウムCH3COONaなどの弱酸の塩の電離によって生じたCH3COO-などの弱酸のイオンは,水溶液中では水H2OからH+を受け取って酢酸CH3COOHなどの弱酸になる。その際にOH-ができるので酢酸ナトリウムの水溶液は塩基性を示す。 CH3COO-
+ H2O → CH3COOH
+ OH- また,電離度がほぼ1である強酸の電離によって生じるCl-,NO3-,SO42-などのイオンは,水溶液中で安定に存在し,水とは反応しない。 NH4+など弱塩基のイオン 弱酸と同様に,弱塩基のイオンは弱塩基の電離からその性質を考えることができる。弱塩基であるアンモニアNH3は電離が小さいので,「⇄」の電離をする。 NH3 + H2O ⇄ NH4+ +
OH- 電離度が小さいので,多くはNH3 + H2O の形(反応式の左)で存在する。つまり,上の式では「←」のほうが起こりやすく,アンモニウムイオンNH4+はOH-があれば結合してNH4OH (NH3
+ H2Oに相当する)になる傾向が強い。そのため,塩化アンモニウムなどの弱塩基塩の電離によって生じたNH4+などの弱塩基のイオンは,水溶液中では水H2OからOH-を受け取ってNH4OH (NH3+H2Oに相当)などの弱塩基になる。その際にH+ができるので塩化アンモニウムの水溶液は酸性を示す。 NH4+
+ H2O → NH4OH
+ H+ また,電離度がほぼ1である強塩基の電離によって生じるNa+,K+,Ca2+,Ba2+などのイオンは,水溶液中で安定に存在し,水とは反応しない。 塩の水溶液 塩の種類と水に溶かしたときの液性をまとめると次のようになり,形式的にもとの酸と塩基の強弱で判断できる(強いほうの性質を言えばよい)。例外があるので注意。 |
||
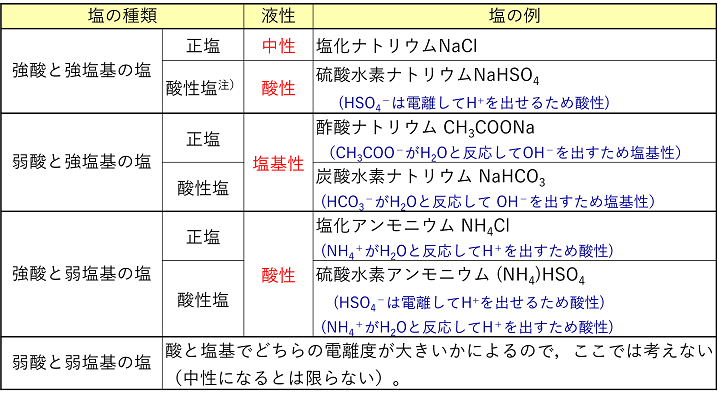
注)強酸と強塩基の酸性塩の場合は,〔 酸性 〕を示す。 |
||
|
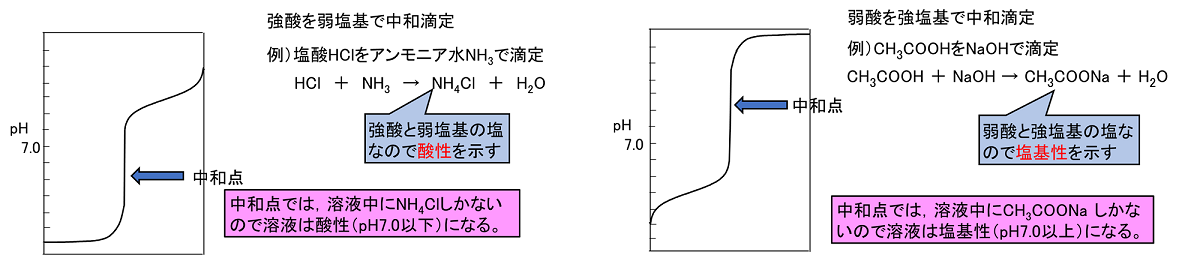
中和滴定で中和点に達したときの溶液のpHについて考えると,生成した塩の液性によって中和点は酸性側になったり塩基性側になったりする。HClとNaOHの中和では,NaCl(中性)ができるので中和点は,ほぼ〔 pH=7 〕となる。CH3COOHとNaOHの中和ではCH3COONa(塩基性)ができるので中和点は〔 塩基性 〕側になり,HClとNH3の中和ではNH4Cl(酸性)ができるので中和点は〔 酸性 〕側になる。 |
||
 |
||
|
(1) 酢酸カルシウム (2) 硫酸ナトリウム (3) 塩化銅(Ⅱ) (4) 硝酸アンモニウム (5) 炭酸水素ナトリウム (6) 硫酸水素カリウム (1) 塩基性 (2) 中性 (3) 酸性 (4) 酸性 (5) 塩基性 (6) 酸性 【弱酸・弱塩基の遊離】 弱酸の塩である酢酸ナトリウムCH3COONaの水溶液に強酸である塩酸HClを加えると,弱酸である酢酸CH3COOHができる。これを〔 弱酸の遊離 〕という。また,弱塩基の塩である塩化アンモニウムNH4Clの水溶液に強塩基である水酸化ナトリウムNaOHの水溶液を加えると,弱塩基であるアンモニアNH3ができる。これを〔 弱塩基の遊離 〕という。 |
||
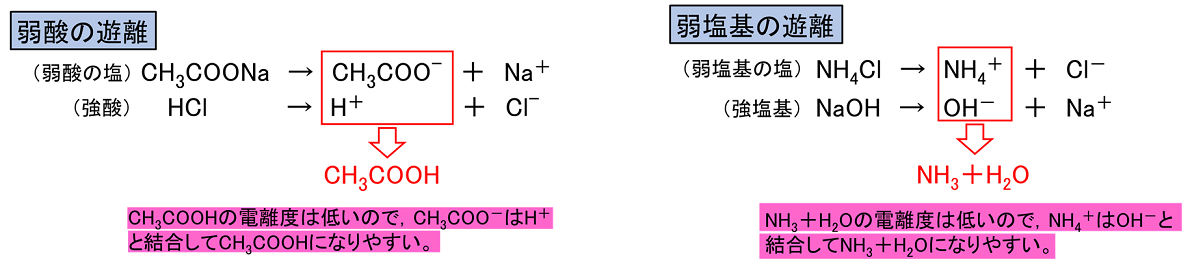 |
||
|
例題 次の塩の中で硫酸を加えると,気体を発生するものをすべて選べ。 ① 炭酸カルシウム ② 塩化カルシウム ③ 硫酸ナトリウム ④ 炭酸水素ナトリウム ⑤ 硝酸カリウム ⑥ 酢酸ナトリウム 硫酸と反応するものは,弱酸の塩 ①,④,⑥ 気体を発生するのは炭酸塩 ①,④ CO2 + H2O (H2CO3)が遊離する。 (⑥は酢酸が遊離するが気体ではない)
問題演習 1 次の各水溶液の水素イオン濃度とpHを求めよ。ただし,原子量:H=1.0,O=16,Na=23, S=32を用いよ。Kw=1.0×10-14[(mol/L)2]とする。 (1) pH=4の塩酸を水で100倍に薄めた水溶液。 (2) 水酸化ナトリウム2.0gを水に溶かして,500mLにした水溶液。 (3) 0.10mol/Lのアンモニア水(アンモニアの電離度をα=0.01とする) (1) [H+]=1.0×10-6〔mol/L〕 pH=6 (2) [H+]=1.0×10-13〔mol/L〕 pH=13 (3) [H+]=1.0×10-11〔mol/L〕 pH=11 (4) [H+]=1.0×10-7〔mol/L〕 pH=7 (5) [H+]=1.0×10-1〔mol/L〕 pH=1 2 [実験Ⅰ]と[実験Ⅱ]によって食酢の濃度を求めた。下の各問に答えよ。ただし,数値は有効数字2桁で求め,食酢中の酸は酢酸のみであるとする。H=1.0 C=12 O=16 [実験Ⅰ] ② 水酸化ナトリウム約4gを水に溶かして1000mLの溶液をつくった。 [実験Ⅱ] 食酢を正確に5倍に薄めた水溶液をつくり,その10mLを実験Ⅰで濃度を求めた水酸化ナトリウム水溶液で滴定すると,中和点までに15.0mLを要した。食酢の密度を1.0g/cm3とする。 (1) ( a) ~ ( d )に入る最も適当な実験器具の名称を答えよ。 (5) 薄める前の食酢中の酢酸のモル濃度〔mol/L〕と質量パーセント濃度を求よ。 (1) (a) メスフラスコ (b) ホールピペット (c) コニカルビーカー (d) ビュレット シュウ酸の物質量=3.15/126=0.025〔mol〕。これを500mL(=0.500L)にしているので,シュウ酸のモル濃度=0.025/0.500=0.0500〔mol/L〕。NaOHのモル濃度をx mol/Lとすると,cva=c’v’b(中和の公式)より,0.0500×10×2=x ×10.2×1, x =0.0980〔mol/L〕。 (NaOHは潮解性という性質(空気中の水分を吸収する性質)があるので,正確な質量が測定できないので「約4g」となっている。そのためNaOHは正確な濃度の溶液を調整できない。そこで,正確な濃度が調整できるシュウ酸で滴定して正確な濃度を求めている。) (4) フェノールフタレイン (5) 0.74mol/L 4.4% 5倍に薄めた食酢(CH3COOH水溶液)のモル濃度をxとすると,cva=c’v’b(中和の公式)より,x×10×1=0.0980×15.0×1, x =0.147〔mol/L〕。元の食酢は,5倍濃いので,0.147×5=0.735〔mol/L〕。これを質量パーセント濃度にする。食酢1L(=1000cm3)は,密度が1.0g/cm3なので,1000×1.0=1000〔g〕。この中にCH3COOH(分子量60,1molで60g)が0.735mol(=0.735×60=44.1g)あるので,質量パーセント濃度は,44.1/1000×100=4.41≒4.4〔%〕 |
||
|
||
|
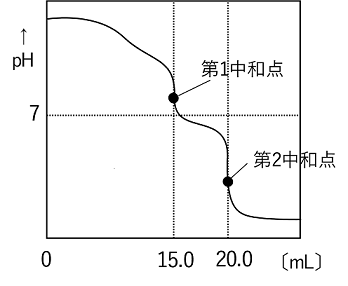
炭酸水素ナトリウムは,弱酸と強塩基の中和による塩なので,強酸である塩酸と反応(弱酸の遊離を)する。また,その水溶液は塩基性を示す。つまり,水酸化ナトリウムと炭酸水素ナトリウムの混合水溶液に塩酸を滴下すると,塩酸は水酸化ナトリウムと炭酸ナトリウムの両方と反応する。 混合水溶液に塩酸を滴下していったときの滴定曲線には,図のように第一中和点と第二中和点が見られる。それぞれの中和点での反応は次の通りである。炭酸ナトリウムは二段階で反応する。 第一中和点: NaOH + HCl → NaCl +
H2O Na2CO3 + HCl → NaHCO3 + NaCl 第二中和点; NaHCO3 + HCl → NaCl + CO2 + H2O そこで,水酸化ナトリウムをxmol,炭酸ナトリウムをymolとする。第一中和点までで必要となる塩酸は(x+y)molとなる。ここまでで,1.0mol/Lの塩酸を15.0mL使っているので,このときの塩酸は, 1.0×15.0/1000=1.50×10-2〔mol〕 したがって, x+y=1.50×10-2 … ① 第二中和点までの反応は,第一中和点までに生成したNaHCO3と塩酸の反応である。Na2CO3 xmolからNaHCO3はxmol生成するので,このNaHCO3と反応するのに使われる塩酸はxmolである。このとき,1.0mol/Lの塩酸を20.0-15.0=5.0〔mL〕使っているので,塩酸は, 1.0×5.0/1000=5.0×10-3〔mol〕 したがって, x=5.0×10-3 … ② ①と②より, 水酸化ナトリウム1.0×10-2〔mol〕 炭酸ナトリウム5.0×10-3〔mol〕 |
||
 |